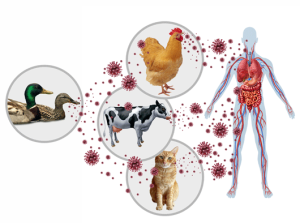
 L’influenza aviaria ad alta patogenicità (HPAI) in particolare il ceppo H5N1, sta generando una preoccupazione a livello globale a causa della sua rapida e vasta diffusione.
L’influenza aviaria ad alta patogenicità (HPAI) in particolare il ceppo H5N1, sta generando una preoccupazione a livello globale a causa della sua rapida e vasta diffusione.
La situazione è considerata un’emergenza per i seguenti motivi:
- Diffusione tra specie diverse
Il virus, che colpisce principalmente gli uccelli selvatici, si sta diffondendo a un numero crescente di specie diverse, inclusi mammiferi come gatti, volpi, foche, orsi e persino vacche da latte negli USA. Questo allargamento del raggio d’azione del virus e del range di ospiti recettivi aumenta la complessità del suo controllo, sorveglianza e monitoraggio. La trasmissione avviene tipicamente per contatto diretto con animali infetti o tramite ambienti contaminati.
- Impatto su animali domestici e selvatici
Il virus H5N1 ha causato focolai devastanti negli allevamenti di pollame in tutto il mondo, con tassi di mortalità elevati, portando all’abbattimento di milioni di animali. Negli uccelli selvatici, la malattia ha provocato un numero senza precedenti di decessi in diverse specie. Oltre alle conseguenze sulla salute animale, la diffusione ha un impatto economico significativo, con restrizioni commerciali e carenza di prodotti come le uova.
- Rischio per la salute umana
Sebbene la trasmissione da animale a uomo sia rara e non sia stata ancora segnalata una trasmissione sostenuta da persona a persona, l’infezione umana è possibile, soprattutto per chi ha contatti stretti e prolungati con animali infetti o ambienti contaminati. Le infezioni umane possono causare sintomi che variano da lievi a gravi, fino alla morte. La principale preoccupazione, che spinge a un monitoraggio costante, è che il virus possa mutare e acquisire la capacità di diffondersi facilmente tra gli esseri umani, scatenando una potenziale pandemia.
Le organizzazioni internazionali come l’Organizzazione per l’alimentazione e l’agricoltura (FAO) e l’Organizzazione mondiale della sanità (OMS) stanno lavorando per monitorare la situazione, valutare i rischi e supportare i Paesi nella gestione dell’emergenza. Vengono implementate misure di prevenzione e controllo, come la sorveglianza, la quarantena e l’adozione di rigorose misure di biosicurezza negli allevamenti, per limitare la diffusione del virus.
A Foz do Iguaçu, in Brasile, si è tenuto di recente un evento storico che ha promosso il primo dialogo multisettoriale globale per contrastare la rapida diffusione dell’influenza aviaria ad alta patogenicità (HPAI) e coordinare una risposta efficace trasversale contro questa minaccia emergente L’evento, organizzato dalla FAO in collaborazione con il Ministero dell’Agricoltura e dell’Allevamento brasiliano, ha visto la partecipazione di circa 500 esperti rappresentanti della sanità pubblica, della politica, ma soprattutto per la prima volta anche rappresentanti del settore privato (come produttori di pollame e servizi sanitari per animali), riconoscendo il loro ruolo cruciale nella gestione e prevenzione della malattia.
L’importanza di questo evento è legata alla rapida diffusione di HPAI a partire dal 2020 che ha causato gravi danni non solo al settore avicolo, ma anche alla biodiversità e alla sicurezza alimentare. I dati scientifici di sorveglianza genomica ci dicono che il virus, che ha già infettato 83 specie di mammiferi, inclusi bovini da latte, non è più una minaccia sporadica ma una sfida globale e rappresenta una delle più gravi minacce pandemiche attuali. Il messaggio che emerge da questo evento rivolto a tutti gli stakeholders, rappresentanti politici ed enti regolatori è che nessun singolo paese o settore può affrontarla da solo, e il fallimento non è un’opzione. La trasparenza e la collaborazione tra paesi, settori produttivi e comunità scientifica sono essenziali per proteggere la sicurezza alimentare globale. Su queste premesse l’incontro si è focalizzato sulla Strategia Globale per la Prevenzione e il Controllo dell’HPAI, lanciata da FAO e WOAH (Organizzazione Mondiale per la Salute Animale).
I temi principali del dialogo sono stati:
- Strategie di prevenzione e controllo: Individuare le migliori pratiche, soprattutto nei paesi a basso reddito.
- Sistemi di allerta e misure di sicurezza: Promuovere sistemi di allarme rapido, vaccinazioni e misure di biosicurezza.
- Approccio “One Health“: Migliorare il coordinamento multisettoriale per affrontare la salute umana, animale e ambientale in modo integrato.
- Soluzioni innovative: Condividere soluzioni all’avanguardia per la diagnostica, la sorveglianza e la risposta agli focolai.
Come riassunto da un esperto della FAO, “Una migliore sorveglianza, la biosicurezza e, se opportuno, la vaccinazione, unite a un rapido controllo della malattia, sono le chiavi per il suo contenimento“. L’incontro ha sottolineato l’importanza di un approccio olistico e della partnership con il settore privato per ridurre il rischio di influenza aviaria per le generazioni future.
Maurizio Ferri
Responsabile scientifico SIMeVeP
 L’influenza aviaria A (H5N1) è una malattia degli uccelli altamente contagiosa che ha già infettato milioni di uccelli e ora appare in alcuni mammiferi.
L’influenza aviaria A (H5N1) è una malattia degli uccelli altamente contagiosa che ha già infettato milioni di uccelli e ora appare in alcuni mammiferi. L’influenza aviaria ad alta patogenicità (HPAI) in particolare il ceppo H5N1, sta generando una preoccupazione a livello globale a causa della sua rapida e vasta diffusione.
L’influenza aviaria ad alta patogenicità (HPAI) in particolare il ceppo H5N1, sta generando una preoccupazione a livello globale a causa della sua rapida e vasta diffusione. Aironi, garzette, gallinelle d’acqua e fagiani comuni potrebbero rappresentare anelli importanti nella catena di trasmissione del virus dell’influenza aviaria dagli uccelli selvatici al pollame allevato nel Nord Italia, svolgendo il ruolo di “ospiti ponte” tra le aree umide frequentate dalle specie in cui il virus si mantiene (come germani reali e gabbiani) e gli allevamenti avicoli.
Aironi, garzette, gallinelle d’acqua e fagiani comuni potrebbero rappresentare anelli importanti nella catena di trasmissione del virus dell’influenza aviaria dagli uccelli selvatici al pollame allevato nel Nord Italia, svolgendo il ruolo di “ospiti ponte” tra le aree umide frequentate dalle specie in cui il virus si mantiene (come germani reali e gabbiani) e gli allevamenti avicoli. La migrazione stagionale degli uccelli selvatici e l’importazione di alcuni prodotti statunitensi, come quelli contenenti latte crudo, potrebbero costituire potenziali vie di introduzione in Europa del genotipo dell’influenza aviaria ad alta patogenicità (HPAI) che attualmente colpisce le vacche da latte statunitensi, secondo un nuovo rapporto pubblicato dall’EFSA. Finora questo tipo di virus non è stato segnalato in nessun altro Paese oltre agli Stati Uniti.
La migrazione stagionale degli uccelli selvatici e l’importazione di alcuni prodotti statunitensi, come quelli contenenti latte crudo, potrebbero costituire potenziali vie di introduzione in Europa del genotipo dell’influenza aviaria ad alta patogenicità (HPAI) che attualmente colpisce le vacche da latte statunitensi, secondo un nuovo rapporto pubblicato dall’EFSA. Finora questo tipo di virus non è stato segnalato in nessun altro Paese oltre agli Stati Uniti. È stato pubblicato il 29 Gennaio 2025 il Rapporto Interagenzia ECDC-EFSA sulle indagini e gestione coordinate One Health dei focolai causati dai virus zoonotici dell’influenza aviaria nell’uomo e animali.
È stato pubblicato il 29 Gennaio 2025 il Rapporto Interagenzia ECDC-EFSA sulle indagini e gestione coordinate One Health dei focolai causati dai virus zoonotici dell’influenza aviaria nell’uomo e animali. L’Organizzazione delle Nazioni Unite per l’Alimentazione e l’Agricoltura (FAO) ha pubblicato le nuove linee guida per aiutare i Paesi membri a implementare programmi di sorveglianza per l’identificazione precoce dell’influenza aviaria nei bovini e altri mammiferi allevati. Lo si apprende da una
L’Organizzazione delle Nazioni Unite per l’Alimentazione e l’Agricoltura (FAO) ha pubblicato le nuove linee guida per aiutare i Paesi membri a implementare programmi di sorveglianza per l’identificazione precoce dell’influenza aviaria nei bovini e altri mammiferi allevati. Lo si apprende da una  Il virus dell’influenza aviare H5N1 corre e acquisisce mutazioni di adattamento ai mammiferi con il rischio di una nuova potenziale pandemia.
Il virus dell’influenza aviare H5N1 corre e acquisisce mutazioni di adattamento ai mammiferi con il rischio di una nuova potenziale pandemia. Il virus altamente patogeno dell’influenza aviaria H5N1, che negli Stati Uniti ha raggiunto anche la popolazione bovina, si trasmette nei mammiferi attraverso il latte vaccino, infettando i topi, che, per esposizione, possono passarlo ai furetti. Questo, in estrema sintesi, è quanto emerge da uno
Il virus altamente patogeno dell’influenza aviaria H5N1, che negli Stati Uniti ha raggiunto anche la popolazione bovina, si trasmette nei mammiferi attraverso il latte vaccino, infettando i topi, che, per esposizione, possono passarlo ai furetti. Questo, in estrema sintesi, è quanto emerge da uno  A seguito della diffusione del virus influenzale H5N1 ad alta patogenicità (HPAI) negli allevamenti degli Stati Uniti, gli Istituti Zooprofilattici Sperimentali delle Venezie (IZSVe) e della Lombardia ed Emilia-Romagna (IZSLER), in accordo con il Ministero della Salute, si sono resi disponibili ad organizzare test sperimentali su bovini e latte crudo allo scopo di produrre dati scientifici utili ad una valutazione del rischio e per una precisa diagnosi, qualora dovessero presentarsi eventuali riscontri sul territorio nazionale di casi analoghi a quelli statunitensi.
A seguito della diffusione del virus influenzale H5N1 ad alta patogenicità (HPAI) negli allevamenti degli Stati Uniti, gli Istituti Zooprofilattici Sperimentali delle Venezie (IZSVe) e della Lombardia ed Emilia-Romagna (IZSLER), in accordo con il Ministero della Salute, si sono resi disponibili ad organizzare test sperimentali su bovini e latte crudo allo scopo di produrre dati scientifici utili ad una valutazione del rischio e per una precisa diagnosi, qualora dovessero presentarsi eventuali riscontri sul territorio nazionale di casi analoghi a quelli statunitensi.